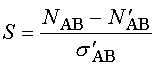[ Moscow University ] [ Brain Research Group ] [ Research ]
|
С.Л.Шишкин,
А.Я.Каплан. Некоторые топографические закономерности синхронности сдвигов
мощности альфа-активности в ЭЭГ человека // Физиология человека. 1999. Т. 25,
№6. С. 5-14. |
|
УДК 612.821+612.822.3.087 |
|
Некоторые топографические закономерности синхронности сдвигов мощности
альфа-активности в ЭЭГ человека С.Л.Шишкин,
А.Я.Каплан Аннотация: Пространственная
синхронность электрической активности коры головного мозга изучалась на
основе подсчета числа совпадений во времени резких изменений (сдвигов)
характеристик ЭЭГ в ее различных отведениях. Данный подход к анализу
пространственной синхронности принципиально отличается от традиционного
корреляционного и когерентного анализа. Индекс синхронности сдвигов мощности
альфа-активности 8-канальных ЭЭГ 12 испытуемых при спокойном бодрствовании с
закрытыми глазами зависел от топографических факторов: он оказался выше в
передних областях, а также тем выше, чем меньше межэлектродное расстояние.
Тенденция к поддержанию этих закономерностей превалировала над противоположной
в 277 из 294 интервалов ЭЭГ длительностью 14 с. Найденные закономерности
подтвердились при анализе 16-канальной ЭЭГ одного испытуемого с расположением
электродов в виде цепочки, идущей ото лба к затылку. Кроме того, в последнем
случае в зависимости индекса синхронности от межэлектродного расстояния
выявились аномалии, которые могут свидетельствовать об отражении в нем
функциональной связанности корковых зон. При открытых глазах в сравнении с
закрытыми индекс синхронности сдвигов мощности альфа-активности в группе из
12 испытуемых значимо падал в пределах передних областей коры и рос между
затылочными и некоторыми передними областями, однако не изменялся в паре
отведений O1O2. Полученные результаты демонстрируют большие потенциальные
возможности используемого подхода к анализу пространственной синхронности
ЭЭГ. |
|
Введение Традиционный подход к изучению суммарной электрической активности коры головного мозга, в рамках которого используется спектральный, корреляционный и когерентный анализ ЭЭГ, основан на допущении, что ЭЭГ можно рассматривать как сигнал со сравнительно неизменными во времени статистическими характеристиками. Это допущение находится в противоречии как с опытом исследователей и клиницистов, визуально анализирующих ЭЭГ [1, 2], так и с данными статистического анализа, выявляющего высокую степень нестационарности ЭЭГ-сигнала [3, 4] и большое разнообразие представленных в нем спектральных паттернов [5, 6, 7]. Более того, если придерживаться мнения, что в ЭЭГ в той или иной мере отражаются кратковременные вариации состояния мозга и его отдельных систем, а также динамика определенных физиологических коррелятов быстро протекающих психических процессов [8, 9], потребность в развитии методов, нацеленных на выявление и анализ кратковременных сдвигов в ЭЭГ, представляется очевидной [10]. Одной из проблем, при решении которой учет нестационарности ЭЭГ может быть полезным, является анализ синхронности электрической активности в различных областях коры. Изучение пространственной синхронности ЭЭГ даже при неизменном состоянии испытуемого, проводившееся многими исследователями в рамках корреляционного и когерентного анализа, позволяет судить, по меньшей мере, о связанности механизмов генерации колебаний [11-14]. Применявшиеся в этих работах показатели корреляции и когерентности предполагают выявление общего сходства динамики всей кривой ЭЭГ или ее спектральных компонентов. Однако оценки синхронности ЭЭГ-сигналов можно получать иным путем - предварительно выделяя в ЭЭГ “события”, имеющие (хотя бы гипотетически) особое физиологическое значение. Можно, в частности, предположить, что существенная часть резких смещений (сдвигов) амплитуды или мощности некоторых спектральных компонентов ЭЭГ, таких, как альфа-активность, связана с функционально значимыми микроперестройками режима активности ее генераторов - например, соответствующими переходам от выполнения одной операции к другой. В этом случае возможную временную согласованность сдвигов изучаемой характеристики в разных отведениях ЭЭГ можно использовать для получения показателя синхронности работы различных корковых зон, имеющего существенно иной смысл, нежели традиционные показатели корреляции и когерентности [15-18]. Анализ сдвигов в различных характеристиках ЭЭГ и их синхронности [15-20] стал возможным благодаря специальному методу детекции сдвигов [21], разработанному на основе непараметрического подхода к проблеме поиска изменений сигнала [22]. Однако применявшаяся ранее версия метода обеспечивала детекцию не более 3-4 изменений ЭЭГ-сигнала в записях длительностью одна минута, тогда как для получения достаточно устойчивых оценок частоты совпадения изменений, по-видимому, требуется выявлять их приблизительно на порядок больше. После существенной модернизации метод обеспечил возможность находить и сравнительно небольшие сдвиги, выявляя с достаточной надежностью в среднем более одного сдвига мощности альфа-активности в секунду [23, 24], что позволило разработать методику получения стабильных оценок синхронности сдвигов в парах отведений ЭЭГ [18]. Настоящая статья посвящена анализу базовых топографических закономерностей синхронности сдвигов мощности в альфа-полосе ЭЭГ человека с применением этой методики. |
|
Методика Регистрация ЭЭГ. В основной серии экспериментов ЭЭГ регистрировалась монополярно в стандартных отведениях O1, O2, P3, P4, C3, C4, F3, F4 у 12 здоровых испытуемых мужского пола (18-26 лет), составлявших 6 пар монозиготных близнецов. (В связи с недостаточным объемом материала специальный анализ генетических закономерностей не проводился, однако наличие близнецовых пар способствовало более полной оценке закономерностей межиндивидуальной вариативности полученных результатов.) Регистрация проводилась в слабо освещенной камере с частичной звукоизоляцией, в состоянии спокойного бодрствования с закрытыми или открытыми глазами; в последнем случае у всех испытуемых наблюдалось хорошо выраженное снижение затылочного альфа-ритма. Каждый испытуемый принимал участие в двух экспериментах с перерывом от трех до одиннадцати дней, в каждом из которых записывалось в состоянии спокойного бодрствования с закрытыми глазами от 2 до 5, с открытыми глазами - 1 или 2 одноминутные ЭЭГ; записи одного из 24 экспериментов были утрачены по техническим причинам. Анализировались записи, не содержавшие выраженных артефактов. В дополнительном эксперименте принял участие один испытуемый, мужчина 24 лет с хорошо выраженным альфа-ритмом. ЭЭГ регистрировалась также монополярно, но с помощью цепочки из 16 электродов, равномерно расположенных вдоль линии, проходящей по правой половине головы от затылка ко лбу. При этом первый электрод находился в позиции O2, пятый - приблизительно соответствовал P4, девятый - C4 и тринадцатый - F4; начиная с номера тринадцать и выше, электроды устанавливались кпереди от F4; все остальные электроды находились в промежутках между упомянутыми позициями. В состоянии спокойного бодрствования с закрытыми глазами было записано 10 одноминутных ЭЭГ. Поскольку ни одна из них не содержала существенных артефактов, все они использовались в дальнейшем анализе. Во всех случаях использовались хлорсеребряные электроды диаметром 8 мм. В качестве референтных служили соединенные электроды на мочках ушей. Электрическое сопротивление не превышало 5 Ком. ЭЭГ предварительно пропускалась через фильтр в полосе 0,53 - 30 Гц и оцифровывалась с частотой 128/с. Детекция сдвигов мощности альфа-активности. Для анализа динамики мощности альфа-активности ЭЭГ, зарегистрированная в каждом из отведений, подвергалась цифровой фильтрации в полосе альфа-ритма (7,5-12,5 Гц), после чего полученные значения возводились в квадрат [9, 25]. Для цифровой фильтрации использовался фильтр Баттерворта. Полученная числовая последовательность обрабатывалась с помощью программы “VERDIA” (авторы - Б. Е. Бродский, Б. С. Дарховский, С. Л. Шишкин), реализующей непараметрический метод детекции моментов резких изменений сигнала [23, 24], и в результате для каждого из отведений определялись моменты времени, в которые происходили выраженные сдвиги мощности в альфа-полосе ЭЭГ. Анализ синхронности сдвигов мощности. Для оценки синхронности подсчитывалось число пар сдвигов из двух разных отведений, разница во времени между которыми не превышала заданный порог. Учитывая, что число сдвигов в среднем несколько различается для разных отведений и вообще является случайной величиной, существенно варьирующей на коротких интервалах времени, при оценке синхронности вводилась поправка на число случайно “синхронизовавшихся” пар сдвигов (N'AB) и стандартное отклонение для этого числа (s'AB), оценивающиеся по формулам [18]:
где NA, NB - число сдвигов соответственно в отведениях A и B, t - порог, T - длина анализируемого интервала ЭЭГ. По полученным значениям рассчитывалась оценка синхронности сдвигов в парах отведений - индекс синхронности (S): Здесь NAB - число пар “синхронных” изменений (число пар таких сдвигов в отведениях A и B, разность во времени между которыми не превышает порог). Нетрудно видеть, что при отсутствии связи между сдвигами в анализируемых отведениях среднее значение индекса синхронности стремится к нулю, а при наличии тенденции к синхронизации, точнее, к сближению на расстояние не более порога, оно принимает (в среднем) положительные значения. Величина порога была выбрана равной 100 мс на основе предварительных исследований [18], в частности, с учетом того, что ошибка в определении момента сдвига мощности альфа-активности используемым методом в подавляющем большинстве случаев не превышает период альфа-ритма. Расчет синхронности в основной серии проводился по интервалам ЭЭГ длительностью 14 с (в каждой записи длительностью одна минута выделялись по три таких фиксированных интервала), в случае 16-канальной ЭЭГ - длительностью 54 с. |
|
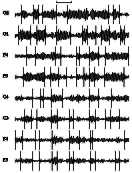
Результаты Сдвиги
мощности альфа-активности и их синхронность. В анализировавшихся ЭЭГ было найдено
от 15 до 119 сдвигов мощности альфа-активности на 1 минуту одного канала
записи (см. табл. 1).
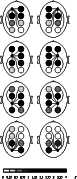
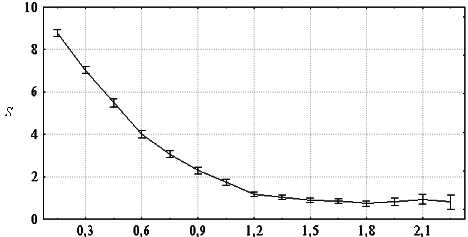
Значения индекса синхронности, усредненные по записям всех испытуемых, оказались положительными для всех пар отведений как при закрытых, так и при открытых глазах, что указывало на превышение числа “синхронных” во времени сдвигов мощности в разных отведениях над теоретически определяемым числом случайно “синхронизовавшихся” пар сдвигов. Однако величина индекса синхронности существенно варьировала в зависимости от пары отведений (рис. 2).
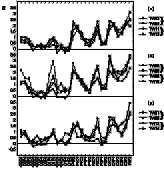
Карты средних по группе значений индекса синхронности, приведенные на рис. 3, показали, что он может существенно зависеть от топографических факторов, а именно от расстояния между электродами и, по-видимому, от расположения электродов на сагиттальной оси. Как видно из рисунка, чем больше расстояние между электродами, тем меньше синхронность, а при равном или почти равном расстоянии между электродами синхронность тем выше, чем они ближе ко лбу: так, синхронность для лобной пары электродов заметно выше синхронности для затылочной пары. Небольшая асимметрия синхронности, которую можно видеть для некоторых пар отведений, находилась в пределах ошибки. Влияние топографических факторов на индекс синхронности. Для уточнения выявленных закономерностей мы провели регрессионный анализ влияния расстояния между электродами и расположения электродов на сагиттальной оси на средние по группе значения синхронности. Межэлектродное расстояние (d) было приблизительно оценено в относительных единицах, исходя из данных о координатах электродов в системе 10-20 для модели головы в виде сферы с единичным радиусом [26]. Расположение электродов относительно оси затылок — лоб (индекс области) оценивалось по формуле a = (aA + aB) / 2, где aA и aB - индексы для каждого из электродов, образующих данную пару, соответственно равные 0,5, 1, 1,5 и 2 для затылочной, теменной, центральной и лобной областей (шкала значений этого индекса была приведена в приблизительное соответствие со шкалой межэлектродных расстояний для удобства сопоставления результатов). Оказалось, что усредненные по группе значения индекса синхронности S, полученные при закрытых глазах для 28 пар электродов, удовлетворительно описываются уравнением линейной регрессии S = -1,20 × d + 1,29 × a + 0,76 (R2=0,73, F(2, 25) = 33,34, p < 0,00001; для коэффициентов при d, a и для константы соответственно t(25)=-6,70, p=0,00001, t(25)=5,94, p=0,00003, t(25)=2,39, p=0,025); несколько хуже они описывались нелинейной зависимостью, в которой на место параметра d подставлялась обратная величина 1/d. Таким образом, предположение о зависимости уровня синхронности от расстояния между электродами и расположения электродов на сагиттальной оси подтвердилось. Однако представляло интерес оценить, проявляется ли данная закономерность уже для неусредненных индивидуальных данных, полученных на коротких интервалах времени. Для этого регрессионный анализ был проведен аналогично описанному выше, но раздельно с данными по 294 интервалам ЭЭГ длительностью 14 с.
Коэффициенты линейной регрессии оказались высоко
стабильными (табл. 2). В частности, для подавляющего большинства интервалов
коэффициент при межэлектродном расстоянии d
был меньше нуля (293 из 294), а
коэффициент при индексе области a -
напротив, выше нуля (277 из 294). Таким образом, практически во всех случаях
оценки синхронности на коротких - 14-секундных - отрезках демонстрировали
одну и ту же тенденцию: синхронность была тем выше, чем меньше межэлектродное
расстояние, и тем ниже, чем ближе электроды находились к затылку. Отметим
также, что средние по испытуемым значения коэффициента kd, отражающего зависимость синхронности от
межэлектродного расстояния, были особенно близкими в парах близнецов (см.
табл. 2). Подробный анализ детерминант синхронности у одного испытуемого. Использование цепочки из 16 электродов, расположенных почти вплотную друг к другу, позволило на примере одного испытуемого дополнительно исследовать некоторые детали выявленных эффектов.
В сравнении с результатами основной серии индекс
синхронности для одних и тех же пар отведений (рис. 4б) оказался более
высоким, что объясняется его оценкой на более длительном интервале (54 с
вместо 14 с). Чтобы обеспечить возможность сопоставления результатов с
данными основной серии, мы и в данном случае при оценке межэлектродных
расстояний взяли за единицу измерения радиус “идеализированной” головы,
представляемой в виде сферы. В соответствии с этим расстояние между центрами
соседних электродов было определено в 0,15 условных единиц (около 1,9 см).
Для позиций O2, P4, C4 и F4 были приняты те же значения индекса области
расположения, как и для основной группы, а для остальных электродов -
соответствующие промежуточные значения, увеличивающиеся пропорционально
порядковому номеру электрода в цепочке: от затылка ко лбу шли значения 0,5
(позиция O2), 0,625, 0,75, 0,875, 1 (P4), 1,125, и т.д. Индекс для пары
электродов рассчитывался в соответствии с этими значениями так же, как и для
данных основной серии. Было получено следующее уравнение линейной регрессии
для индекса синхронности, усредненного по 10 записям: S
= -4,57 × d
+ 1,55 × a
+ 5,45 (R2=0,69, F(2,
117) = 128,4, p < 0,00001; для коэффициентов при d, a и для константы соответственно t(117)=-15,56, p<0,00001, t(117)=3,81,
p=0,00022, t(117)=8,32, p<0,00001).
Нелинейная регрессия, для которой было получено уравнение S
= 1,34 / d + 1,55 × a - 1,26, на этот раз описывала данные
несколько лучше (R2=0,73,
F(2, 117) = 153,3, p
< 0,00001; для коэффициентов при 1/d,
a и для константы соответственно t(117)=17,03,
p<0,00001, t(117)=4,04, p=0,00009,
t(117)=-2,13, p=0,035). Действительно, как видно из рис. 4а, где представлена
зависимость индекса синхронности от межэлектродного расстояния для всех 120
пар электродов, она оказалась ближе к обратной, чем к прямой линейной.
Отметим особенно высокие значения t-критерия
для вклада межэлектродного расстояния d,
которые не наблюдались при анализе данных основной серии; по-видимому, они
были связаны с наличием в данном случае лишь внутриполушарных пар электродов,
для которых можно ожидать более высокую зависимость синхронности от
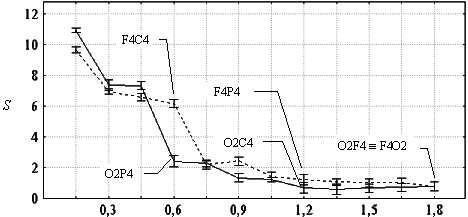
расстояния. При рассмотрении отдельно данных по двум группам пар отведений - включавшим затылочное отведение O2, и по парам, включавшим лобное отведение F4 (рис. 4б) - оказалось, что при межэлектродном расстоянии более 0,45 усл. ед. (приблизительно более 5,7 см) для пар первой группы была характерна более высокая синхронность. Пары O2P4 и F4C4 резко выделились большой разницей синхронности при одном и том же межэлектродном расстоянии. Также обращает на себя внимание немонотонный в целом характер рассматриваемой зависимости в области небольших межэлектродных расстояний (см. рис. 4б).
Различие синхронности при закрытых и открытых глазах. Сравнение индекса синхронности при закрытых и открытых глазах для каждой пары отведений проводилось с помощью парного критерия Вилкоксона по данным основной серии, предварительно усредненным по наборам записей, сделанным у одного испытуемого в один день (n=23). Значимые различия (p<0,05) были найдены в 8 парах отведений из 28. Все пары, для которых уровень значимости различий был не хуже 0,1, отмечены на карте, представленной на рис. 5. Карта выявляет следующую закономерность: в передних областях коры, точнее, во всех парах, включавших только отведения центральной и лобной областей, при закрытых глазах наблюдалась более высокая синхронность сдвигов мощности альфа-активности; при открытых глазах синхронность была более высокой в парах, в состав которых входило одно из затылочных отведений. Отметим, что эти же тенденции наблюдались везде в пределах лобных и центральных областей и во всех парах с участием затылочных отведений также в тех случаях, когда различия не были значимыми, кроме пар O1O2 и O1P4, где усредненная по группе разность значений индекса синхронности не превышала 0,04. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Обсуждение Существование явления синхронности резких изменений в
различных отведениях ЭЭГ уже было показано нами ранее [15-18, 20]. В данной работе,
однако, впервые было проведено подробное изучение пространственной
синхронности сдвигов отдельно взятой характеристики ЭЭГ - мощности
альфа-диапазона ее спектра. Используемый нами показатель чувствителен лишь к
синхронности наиболее выраженных перестроек текущего уровня анализируемой
характеристики, и этим он принципиально отличается от традиционных
показателей корреляции и когерентности. Несмотря на это, выявленные нами
эффект падения синхронности сдвигов при увеличении межэлектродного расстояния
и затылочно-лобный градиент синхронности сдвигов мощности альфа-активности
вполне соответствуют данным, полученным другими исследователями для
корреляции и когерентности [12-14, 27]. Соответствующие тенденции были
обнаружены в подавляющем большинстве проанализированных индивидуальных
14-секундных интервалов, что говорит как об их стабильности, так и о высокой
чувствительности разработанного нами метода оценки синхронности. Сходство
общей картины синхронности в парах близнецов подтверждает неслучайный характер
ее индивидуальных оценок. Данные, полученные у одного испытуемого при
расположении электродов практически вплотную друг к другу в виде цепочки
вдоль правой половины головы, дают возможность попытаться интерпретировать
наблюдавшийся в основной группе затылочно-лобный градиент синхронности, по
крайней мере для внутриполушарных связей, как эффект, обусловленный
гетерогенностью коркового поля альфа-активности. Как видно на рис. 4б, в
небольшой области в передней и задней частях цепочки электродов синхронность
одинаково высокая, однако далее происходит резкое падение, которое в случае,
когда рассматриваются пары с участием O2, происходит с 3-го на 4-й электрод,
считая от исходной точки, т.е. перед P4, а в случае, когда рассматриваются
пары с участием F4 - с 4-го на 5-й электроды, т.е. сразу после C4.
Локализация точек резкого падения индекса синхронности может указывать на
положение границ областей с более тесной внутренней функциональной
связанностью, отражающейся в повышенной синхронности скачкообразных сдвигов в
динамике альфа-активности. В одном случае такая граница приблизительно
совпадает с границей между затылочной и теменной корой, в другом же можно
предположить, что сравнительно однородная область высокой связанности по
альфа-полосе, по крайней мере при закрытых глазах, захватывает как лобную,
так и соматосенсорную кору. Повышенная связанность некоторых областей лобной
и соматосенсорной коры по одному из типов активности альфа-диапазона,
мю-ритму, действительно известна [9]. Если рассматривать только стандартные позиции
электродов, гетерогенность зон коры приведет к кажущейся значительно более
высокой внутриполушарной синхронности в лобно-центральной области (F4C4) в
сравнении с затылочно-теменной (O2P4) при одинаковом межэлектродном
расстоянии (рис. 4б). В связи с этим нельзя исключить, что именно этот эффект
мог отвечать за резкие отличия затылочной области от лобной по
внутриполушарной синхронности сдвигов мощности альфа-диапазона ЭЭГ,
наблюдавшиеся в основной группе. Эффект зависимости синхронности от расстояния часто
объясняют различиями в связанности ближних и дальних участков коры
проводящими путями [12]; многие исследователи склоняются к признанию
значительного вклада объемного проведения потенциала [11, 28].
Общепризнанного объяснения причин более низкой синхронности в задних отделах
коры не существует; важное значение может иметь относительная независимость
работы мощных “генераторов” альфа-ритма в левой и правой затылочной областях
[29, 30]. При обычно применяемой монополярной схеме отведения ЭЭГ возможно
также затекание на референтные ушные или мастоидальные электроды затылочного
альфа-ритма, который способен создавать эффект мнимого присутствия
высококогерентной альфа-активности во всех областях коры, где собственная или
распространяющаяся электротонически к “активному” электроду от генерирующих
зон альфа-активность недостаточно высока [11, 28]. Однако маловероятно, что
сложный характер зависимости синхронности от расстояния в анализировавшихся
нами записях с плотным расположением 16 электродов может определяться только
эффектами, связанными с физическим распространением сигнала; по-видимому,
основной вклад вносят различия функциональной связанности зон коры. Несколько неожиданный результат был получен при
анализе топографии различий синхронности сдвигов мощности альфа-активности
при закрытых и открытых глазах. Во-первых, наибольшее различие было связано
не с затылочной областью, где при открытых глазах альфа-ритм падает больше
всего, а с передними областями коры. (Заметим, кстати, что более низкая
синхронность в этих областях при открытых глазах свидетельствует об
отсутствии существенного вклада в выявленные топографические эффекты
артефактов окулографического происхождения, которые должны были бы дать рост
синхронности, поскольку при открытых глазах они встречаются намного чаще.)
Во-вторых, в затылочных областях при открытых глазах в сравнении с закрытыми
синхронность возросла, хотя вследствие блокады альфа-ритма можно было бы
ожидать снижение качества детекции сдвигов его уровня в этих областях и как
результат - появление более низких оценок синхронности. В настоящее время
объяснения полученных эффектов могут быть лишь чисто спекулятивными.
Возможно, что картина различий поля альфа-активности при закрытых и открытых
глазах имеет более сложный характер, чем это обычно представляется. Можно
предположить, например, что при открытых глазах в лобной ЭЭГ возрастает
относительный вклад активности локальных генераторов альфа-активности
вследствие снижения мощности
генераторных зон затылочной коры. О генераторах альфа-ритмики в
передних корковых областях до сих пор известно крайне мало, но есть основания
считать, что они обладают относительной независимостью [28], и,
следовательно, связанные с деятельностью этих генераторов сдвиги мощности в альфа-полосе могут
регистрироваться под разными электродами в разное время. Сложнее объяснить эффекты роста синхронности сдвигов
ЭЭГ-активности при открывании глаз для пар отведений, включающих затылочные
электроды, особенно с учетом отсутствия при этом изменений синхронности в
паре O1O2. На данном этапе исследований возможно лишь констатировать, что
области генерации наиболее мощного альфа-ритма, т.е. затылочные зоны, теснее
связаны по сдвигам мощности альфа-активности с областями, лежащими впереди
них, при открытых глазах в сравнении с закрытыми глазами. В парах отведений, связанных с затылочной областью, заметна определенная асимметрия значимых эффектов (см. рис. 5), однако, поскольку тенденция с одинаковым знаком выявлялась в таких парах отведений независимо от того, достигался ли уровень значимости, вполне возможно, что эта асимметрия была случайной. В целом результаты данной работы не дают оснований для сколь-нибудь определенных заключений относительно возможности влияния межполушарных различий на синхронность сдвигов альфа-активности. |
|
Выводы 1. Синхронность резких изменений (сдвигов) мощности в
альфа-полосе ЭЭГ человека снижается при увеличении межэлектродного расстояния
и по направлении ото лба к затылку. 2. Эти эффекты стабильно выявляются на коротких
(длительностью 14 с) временных интервалах. 3. При открытых глазах в сравнении с закрытыми синхронность сдвигов мощности альфа-активности падает в пределах передних областей коры и растет между затылочными и некоторыми передними областями. |
|
Благодарности Авторы благодарят Б. С. Дарховского и Б. Е. Бродского за ценные консультации в ходе выполнения работы, Ал. А. и Ан. А. Фингелькурцев - за участие в проведении экспериментов. Работа частично поддержана Российским фондом фундаментальных исследований (грант № 96-04-49144) и фондом "Университеты России - фундаментальные исследования" (грант № 3653). |
|
Литература 1. Berger H. Űber das Elektrenkephalogram des Menschen. II // J. of Psychology and Neurology. 1930. V. 40. P. 160. 2. Боденштайн Г., Преториус Х.М. Выделение признаков из электроэнцефалограммы методом адаптивной сегментации // Тр. Ин-та инженеров по электротехнике и радиоэлектронике. 1977. Т. 65. № 5. С. 59. 3. Elul R. The genesis of the EEG // Internat. Rev. Neurobiol. 1972. V. 15. P. 227. 4. McEven J., Anderson G.B. Modeling the stationarity and gaussianity of spontaneous electroencephalographic activity // IEEE Trans. Biomed. Eng. 1975. V. 22. P. 361. 5. Creutzfeldt O.-D., Bodenstein G., Barlow J.S. Computerized EEG pattern classification by adaptive segmentation and probability density function classification. Clinical evaluation // Electroenceph. clin. Neurophysiol. 1985. V. 60. № 5. P. 373. 6. Бодунов М.В. “Алфавит” ЭЭГ: типология стационарных сегментов ЭЭГ человека // Индивидуально-психологические различия и биоэлектрическая активность мозга человека. М.: Наука, 1988. С. 56. 7. Каплан А.Я., Фингелькурц Ал.А., Фингелькурц Ан.А. и др. Адаптивная классификация динамических спектральных паттернов ЭЭГ человека // Журн. высш. нервн. деятельности. 1998 (в печати). 8. Lehmann D. Fluctuation of functional state: EEG patterns, and perceptual and cognitive strategies // Functional states of the brain: their determinants. Amsterdam: Elsevier, 1980. P. 189. 9. Pfurtscheller G., Neuper C., Andrew C., Edlinger G. Foot and hand area mu rhythms // Internat. J. Psychophysiol. 1997. V. 26. № 1-3. P. 121. 10. Каплан А.Я. Нестационарная ЭЭГ: методологический и экспериментальный анализ // Успехи физиол. наук. 1998 (в печати). 11. Nunez P.L., Srinivasan R., Westdorp A.F., Wijesinghe R.S., Tucker D.M., Silberstein R.B., Cadusch P.J. EEG coherency. I: Statistics, reference electrode, volume conduction, Laplacians, cortical imaging, and interpretation at multiple scales // Electroencephalogr. clin. Neurophysiol. 1997. V. 103. № 5. P. 499. 12. Thatcher R.W., Krause P.J., Hrybyk M. Cortico-cortical associations and EEG coherence: a two-compartmental model // Electroenceph. clin. Neurophysiol. 1986. V. 64. P. 123. 13. Русинов В.С., Гриндель О.М., Болдырева Г.Н., Вакар Е.М. Биопотенциалы мозга человека: математический анализ. М.: Медицина, 1987. 14. Свидерская Н.Е. Синхронная электрическая активность мозга и психические процессы. М.: Наука, 1987. 15. Kaplan A.Ya., Brodsky B.E., Darkhovsky B.S., Shishkin S.L., Fingelkurts Al.A., Fingelkurts An.A. Change-point mapping: a new technique for EEG brain imaging // Human Brain Mapping. 1995. Suppl. 1. P. 97. 16. Каплан А.Я., Дарховский Б.С., Фингелькурц Ал.А., Фингелькурц Ан.А. Топологическое картирование процесса синхронизации переходных периодов в мультиканальной ЭЭГ у человека // Журн. высш. нервн. деятельности. 1997. Т. 45. № 1. С. 32. 17. Kaplan A.Ya., Fingelkurts An.A., Fingelkurts Al.A., Ivashko R.M., Darkhovsky B.S. Topological mapping of sharp reorganization synchrony in multichannel EEG // American J. EEG Technol. V. 37. 1997. P. 265. 18. Шишкин С.Л. Исследование синхронности моментов резких изменений альфа-активности ЭЭГ человека: Автореф. дисс. ... канд. биол. наук. M., 1997. 19. Shishkin S.L., Brodsky B.E., Darkhovsky B.S., Kaplan A.Ya. Change-point detection method may be useful for the revealing of the time-structure of the rhythmic components of human EEG // Fourth IBRO World Congress of Neuroscience (Kyoto, 1995). Oxford: Rapid Communications, 1995. P. 484. 20. Фингелькурц Ан.А., Фингелькурц Ал.А., Ивашко Р.М., Каплан А.Я. Электроэнцефалографический анализ операциональной синхронизации корковых образований головного мозга у человека при мнестической деятельности // Вестн. Моск. ун-та. Сер. 16 (биология). 1998. № 1. С. 3. 21. Brodsky B.E., Darkhovsky B.S., Kaplan A.Ya. Change-point detection method for EEG-signal analysis // Proc. IMACS Internat. Symp. on Signal Processing, Pobotics and Neural Networks. Lille (France), 1994. 22. Brodsky B.E., Darkhovsky B.S. Nonparametric Methods in Change-Point Problems // Dordrecht (the Netherlands): Kluver Acad. Publ., 1993. 23. Шишкин С.Л., Бродский Б.Е., Дарховский Б.С., Каплан А.Я. ЭЭГ как нестационарный сигнал: подход к анализу на основе непараметрической статистики // Физиол. человека. 1997. Т. 23. № 4. С. 124. 24. Brodsky B.E., Darkhovsky B.S., Kaplan A.Ya., Shishkin S.L. A nonparametric method for the segmentation of the EEG // Comp. Meth. Progr. Biomed. (in press). 25. Pfurtscheller G., Aranibar A. Evaluation of event-related desynchronization (ERD) preceding and following voluntary self-paced movement // Electroencephalogr. clin. Neurophysiol. 1979. V. 46. P. 138. 26. Böcker K.B.E., van Avermaete J.A.G., van den Berg-Lenssen M.M.C.. The international 10-20 system revisited: cartesian and spherical co-ordinates // Brain Topography. 1994. V. 6. № 3. P. 231. 27. Шеповальников А.Н., Цицерошин М.Н., Апасионок В.С. Формирование биопотенциального поля мозга человека. Л.: Наука, 1979. 28. Basar E., Schürmann M. Functional correlates of alphas panel discussion of the conference ‘Alpha Processes in the Brain’ // Internat. J. Psychophysiol. 1997. V. 26. № 1-3. P. 455. 29. Adrian E.D., Yamagiwa K. The origin of the Berger rhythm // Brain. 1935. V. 56. № 3. P. 323. 30. Williamson S.J., Kaufman L., Lu Z.-L., Wang J.-Z., Karron D. Study of human occipital alpha rhythm: the alphon hypothesis and alpha suppression // Internat. J. Psychophysiol. 1997. V. 26. № 1-3. P. 63. |
[ Moscow University ] [ Brain Research Group ] [ Research ]
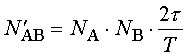 ,
,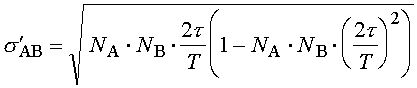 ,
,